昂首凌云迎旭日,云山珠水共逍遥。2020年11月12-15日,“2020中国肿瘤学大会(CCO)”在花城广州隆重召开,这是一场学术盛宴,大会秉承“肿瘤防治,赢在整合”主题,聚焦基础研究、临床研究、成果转化、新品发布、智慧医院等多个领域,与会专家进行了深入解读与探讨。来自青岛大学附属医院乳腺病诊疗中心主任的王海波教授结合2020年欧洲肿瘤内科学会年会(ESMO2020)乳腺癌临床研究热点,为我们阐释三阴性乳腺癌(TNBC)免疫联合化疗的机遇与挑战。

TNBC免疫联合化疗相关机制
肿瘤免疫编辑理论[1]认为,肿瘤的发生、发展过程中,经历了先天和适应性免疫系统控制肿瘤生长和塑造肿瘤免疫原性。此过程包括三个阶段:清除(elimination)、平衡(equilibrium)和逃逸(escape)。正性调控包括:NK细胞、DC细胞、CD8+T细胞等;负性调控包括:PD1、CTLA4、抗原呈递下降等。
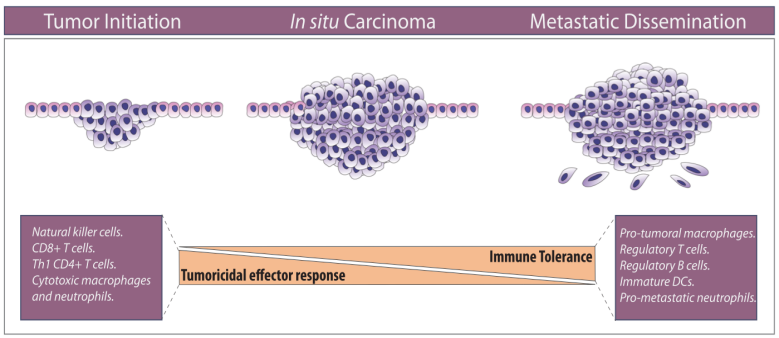
图1. 机体内免疫环境是否平衡决定了肿瘤的走向
肿瘤免疫循环[2]主要包括7个步骤:
1、死亡的肿瘤细胞释放出抗原;
2、抗原与APC(抗原呈递细胞,树突细胞DC是专职抗原呈递细胞)表面的MHC复合物形成抗原肽-MHC复合物;
3、TCR识别APC表面的抗原肽-MHC复合物以及专职APC表面的B7分子和T细胞表面的二聚体分子CD28之间结合,双信号启动使T细胞激活(双信号系统调控可回顾免疫反应及肿瘤免疫治疗);
4、其中细胞毒性T淋巴细胞(CTLs)通过血液循环运输至肿瘤组织;
5、CTLs进入肿瘤组织;
6、识别肿瘤细胞;
7、通过免疫作用杀死肿瘤细胞。
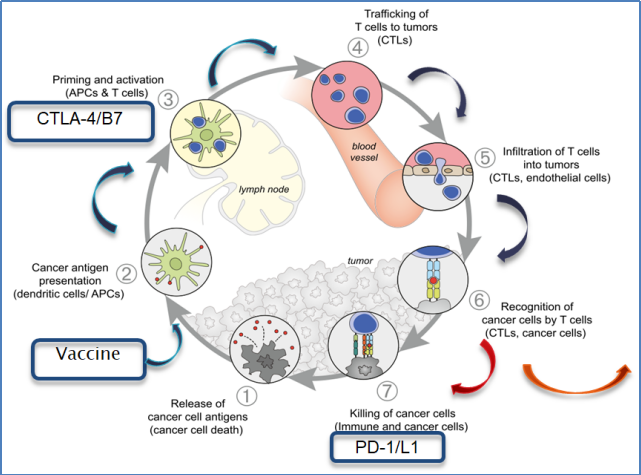
图2. 肿瘤免疫循环7个主要步骤
肿瘤组织中T细胞高表达程序性死亡受体1(PD-1),PD-1受体与活化T细胞结合的抑制特性在生理和病理环境中已得到很好的证实。在癌症中,使用检查点阻断(例如抗PD-1抗体)逐渐成为越来越多肿瘤的参考治疗,多个相关通路的药物陆续问世[3]。
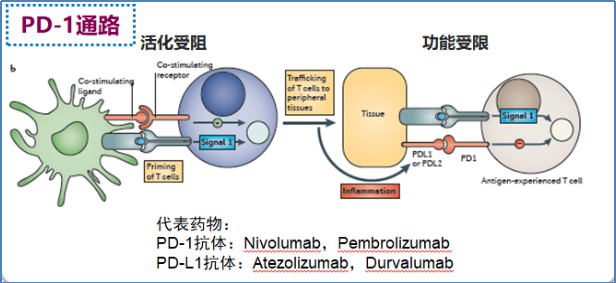
图3. 针对CTLA-4通路或PD-1通路的肿瘤免疫治疗思路
化疗药物具有间接和直接促免疫作用[4]。间接促免疫作用主要体现为消除免疫抑制细胞,如MDSCs、Treg、M2 TAMs等,代表性化疗药物包括5-FU、环磷酰胺、多西他赛、吉西他滨、奥沙利铂、紫杉醇等;直接促免疫作用是指促进免疫效应细胞的激活,如NK的成熟,CTLs的活化,代表性化疗药物包括吉西他滨、紫杉醇、培美曲塞等。化疗通过间接和直接提高肿瘤免疫原性,提呈肿瘤抗原表达及共刺激因子、提升肿瘤免疫识别、提高效应T细胞活性,从而诱导肿瘤细胞凋亡。
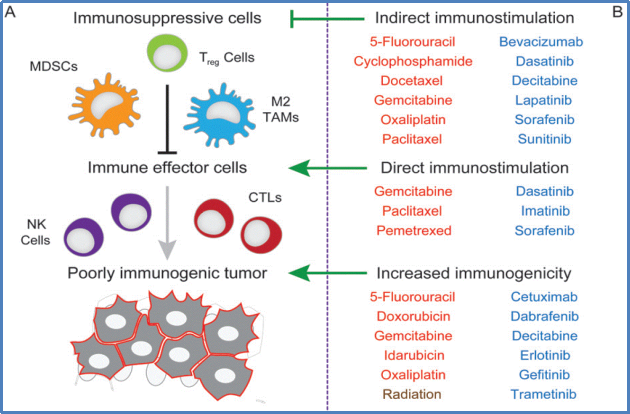
图4. 化疗药物具有间接和直接促免疫作用
乳腺癌是“冷”肿瘤,单独应用免疫治疗疗效可能较差。通过化疗激活免疫,使“冷”肿瘤变“热”肿瘤再行免疫治疗,可显著提高疗效。肿瘤免疫学评分(Immunoscore)为肿瘤分类量化分型与分级提供了新的方法。
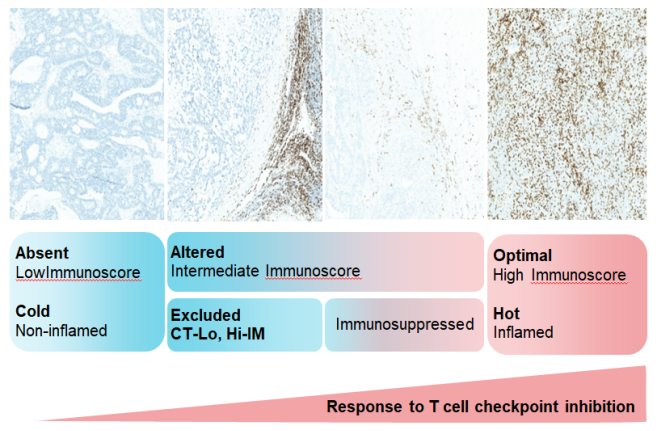
图5. 肿瘤免疫学评分(Immunoscore)为肿瘤分类量化分型与分级提供了新的方法
TNBC是异质性较大的一种乳腺癌,预后非常差,所以临床用药指导急需对TNBC本身更加细致的分类[6]。紫杉类或蒽环类单药化疗为经典晚期疾病一线方案[7-8],不同研究中的中位OS不同,一般约为18个月甚至更短[9-11];目前尚无靶向药物使TNBC患者OS获益,贝伐珠单抗联合化疗在部分国家获批用于治疗转移性乳腺癌(mBC)[12];PARP抑制剂在部分国家获批用于治疗BRCA1/2突变HER2阴性mBC[13]。
既往针对TNBC的免疫治疗药物单药表现出一定的抗肿瘤活性和可控的安全性,其疗效依然有限,临床需要一个策略使肿瘤微环境对免疫治疗药物更敏感。免疫治疗与化疗、放疗、靶向治疗、以及不同的免疫检查点抑制剂的联合,或可帮助提高宿主对肿瘤的免疫应答。化疗可以使肿瘤细胞的抗原释放,增强免疫治疗的效果,因此也有了免疫治疗联合化疗治疗TNBC研究探索[14]。
引领肿瘤学术热潮的2020年ESMO大会近期以线上形式胜利召开。此次盛会,围绕TNBC免疫治疗涌现出了令人振奋的临床数据,给患者带来新的治疗选择和希望:IMpassion031研究结果重磅出世,提示阿替利珠单抗联合化疗(白蛋白紫杉醇/AC)在早期TNBC的新辅助治疗中,可有效提高pCR率,且不论PD-L1表达状态;同为免疫联合化疗的研究IMpassion130研究和IMpassion131研究却得到了完全不同的结果。TNBC免疫联合化疗,机遇与挑战并存。让我们共同回顾这三项TNBC免疫联合化疗研究,进行解读并展开讨论:

1、ESMO2020:IMpassion031研究结果重磅出世[15]
IMpassion031研究是一项随机、国际多中心、双盲的III期临床研究。旨在评估阿替利珠单抗联合化疗(白蛋白紫杉醇/AC)在早期TNBC新辅助治疗中的疗效和安全性。该研究共入组333例患者,1:1随机接受阿替利珠单抗+化疗或安慰剂+化疗。主要研究终点是在意向治疗(ITT)人群和PD-L1阳性人群中评估pCR,次要终点包括总生存期(OS)、无事件生存期、无病生存期和生活质量指标,试验设计见图6。
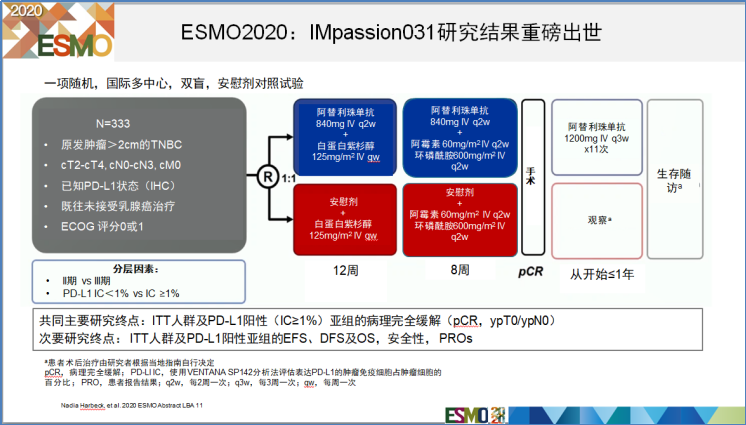
图6. IMpassion031研究设计
研究结果:pCR。试验组与安慰剂组中位随访时间分别至20.6个月和19.8个月,ITT人群中试验组pCR率提高16.5%(57.6% VS 41.1%,P=0.0044),PD-L1阳性患者pCR率提高19.5%(68.8% VS 49.3%,P=0.021),试验组显著提高了TNBC患者pCR率,在手术时可检测到肿瘤组织的患者较少。
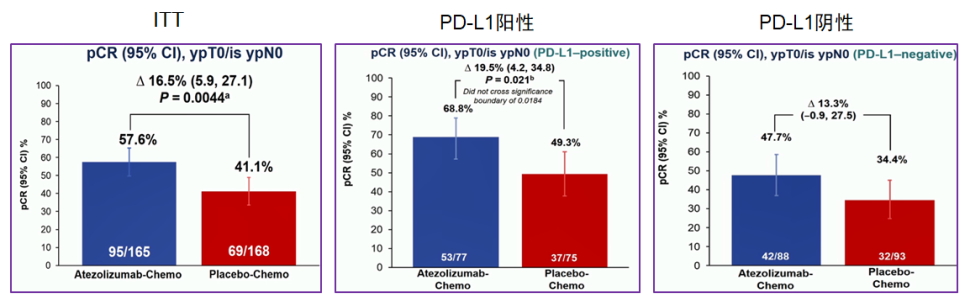
图7. 研究结果:pCR
pCR(ITT)亚组分析结果提示:无论PD-L1状态如何,免疫联合化疗均提高了患者的pCR率。

图8. pCR(ITT)亚组分析结果
研究结果:至事件发生时间(ITT)。为了解新辅助免疫治疗获得的近期疗效能否转化为远期生存的获益,该研究还做了长期生存的探索。不管是EFS、DFS还是OS,都看到新辅助免疫治疗获益的趋势,但是目前长期生存的数据尚不成熟,期待后续随访结果的公布。
表1. 至事件发生时间(ITT)

• EFS,DFS和OS的趋势支持Atezolizumab+化疗组在pCR所观察到的获益
• EFS,DFS和OS尚不成熟,将继续收集数据直到研究进行最终分析为止
研究结果:安全性。通过最常见(≥20%)的AEs分析发现,试验组与安慰剂组治疗相关3-4级不良反应发生率分别为56.7%和53.3%,发生率是相似的,且多数来源于化疗,详见图9。
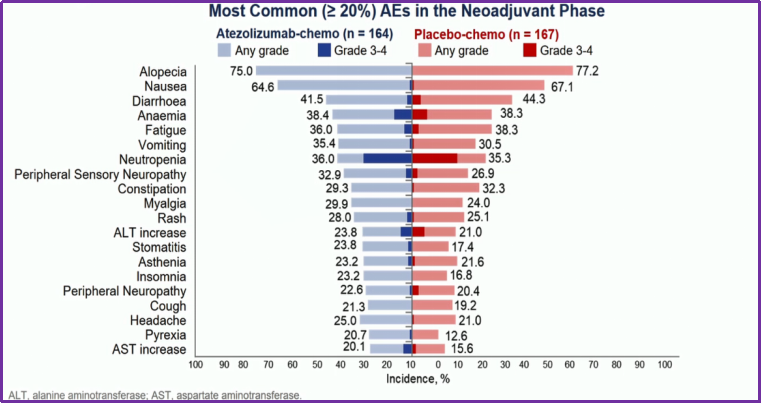
图9. 最常见(≥20%)的AEs
研究结论:阿替利珠单抗联合化疗对比安慰剂+化疗,增加了IIT人群16.5%的pCR率(57.6% vs 41.1%,P=0.0044),取得了显著统计学意义和临床获益,且不论PD-L1状态如何,在整个临床亚组中均观察到获益。尽管数据还不成熟,但EFS、DFS和OS趋势,也支持接受阿替利珠单抗联合化疗患者的pCR获益。阿替利珠单抗联合化疗(白蛋白紫杉醇/AC)的安全性特征与单独药物研究的已知风险一致。
综上,IMpassion031研究证实:阿替利珠单抗联合新辅助化疗治疗II-III期TNBC患者,取得了具有临床意义的pCR获益,安全性可耐受,且不需要考虑患者的PD-L1状态,这种新的组合疗法可能可以为这群存在高度未满足医学需求的患者,提供一种更合适的治疗选择。
2、IMpassion130研究[16]:免疫治疗联合白蛋白紫杉醇在晚期TNBC中的意义
IMpassion130是乳腺癌免疫治疗领域开展的一项重要的多中心临床研究,这项研究目前取得了比较好的结果,也可以说是我们在TNBC或者整个乳腺癌治疗领域取得的一个突破性的进展,下面我们来共同回顾一下IMpassion130的研究进展。
该研究入组了902例不可手术的局部晚期或者转移性乳腺癌患者,1:1随机接受一线阿特利珠单抗联合白蛋白紫杉醇治疗对比安慰剂联合白蛋白紫杉醇治疗,主要研究终点包括PFS和OS,研究设计见图10。
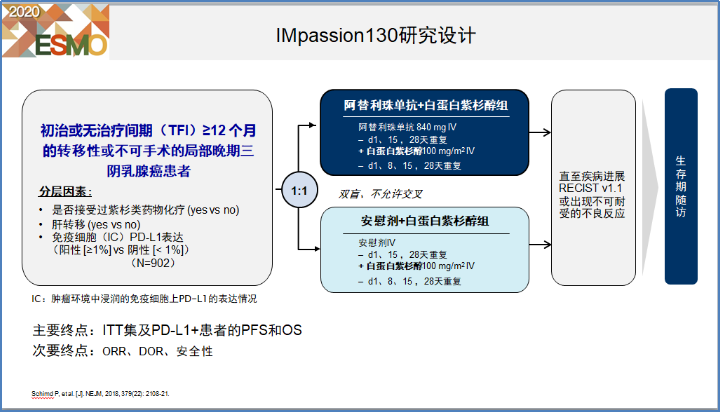
图10. IMpassion130研究设计
此项研究的特殊性在于它的统计学设计,它平行检验了ITT人群和PD-L1阳性这两组人群的PFS的水平。而对于OS是按层级进行检验,先检验ITT人群,获得阳性结果后再针对其中PD-L1阳性人群的OS数据进行进一步分析。这样的检验方法优点在于很大程度上能减少对p值的消耗,控制样本量,增加研究进度。伴随的风险就是,如果首先检验的ITT人群没有统计学差异,后续的PD-L1阳性人群就无法正式检验。但是此研究设计巧妙,对临床研究有一定的促进作用。
图11. IMpassion130临床研究设计及数据检测
2019年ASCO年会上,IMpassion130研究发布了第2次中期分析OS数据及安全性分析,进一步夯实了阿替利珠单抗联合白蛋白紫杉醇这一方案在晚期TNBC中的疗效和安全性分析结果。2019年3月8日,FDA批准白蛋白紫杉醇联合免疫治疗用于治疗治疗PD-L1阳性的转移性三阴乳腺癌。
在ITT人群中,PFS从5.5个月增加到7.2个月(HR=0.8,P=0.002),具有显著统计学差异;在PD-L1阳性人群中,PFS从5.0个月增加到7.5个月(HR=0.62, P<0.001),具有显著统计学差异;PD-L1-人群未见该疗效。见图12。
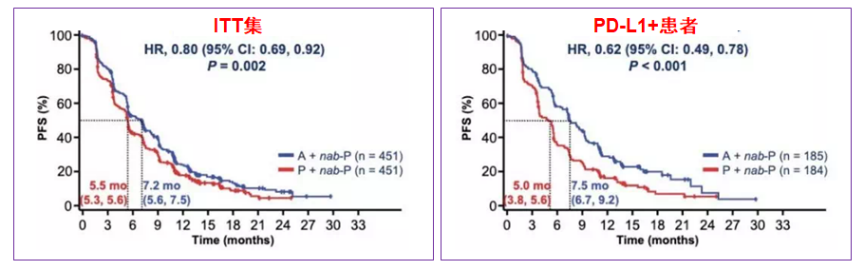
图12. ITT集和PD-L1+人群PFS均显著改善
在ITT人群中,OS未观察到显著统计学差异,在PD-L1阳性患者中,中位OS为25 vs. 18个月,HR 0.71,有7个月的显著改善,超过一半(51%)的患者在2年时存活,见图13。
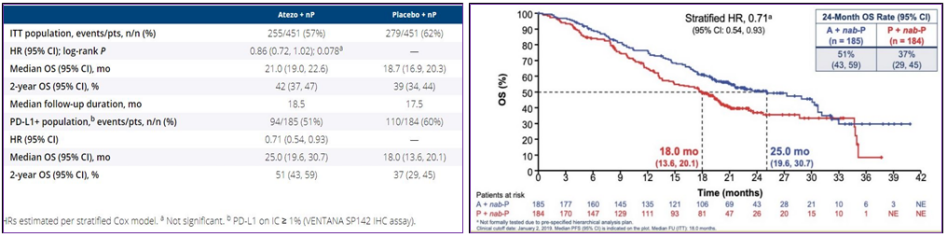
图13. ITT集和PD-L1+人群PFS均显著改善
2020年9月ESMO大会报道了IMpassion130最终的OS结果[17],在ITT人群中,OS未观察到显著统计学差异;在PD-L1阳性患者中,中位OS:25.5 vs. 17.9个月,HR 0.67,阿替利珠单抗联合白紫延长PD-1阳性患者中位OS达7.5个月,PD-L1 IC+人群的OS结果与首次和第二次期中分析一致。
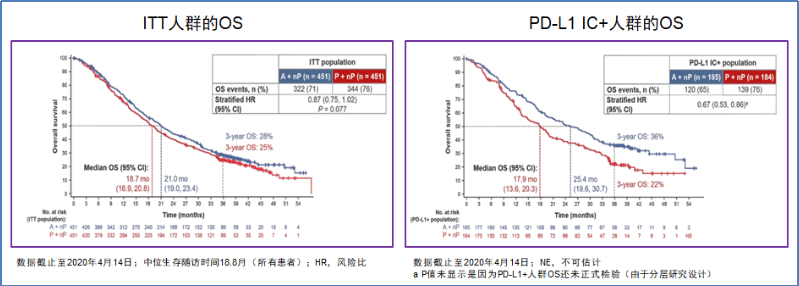
图14. OS最终分析结果
本次2020年ESMO大会也同步报道了长期随访安全性分析数据,发生率≥20%的AEs见图15。安全性长期随访数据显示,阿替利珠单抗联合白紫仍然是安全和可耐受的,其安全性与单独每个治疗药物的安全性一致,没有发现新的影响安全性的信号,这些结果支持了阿替利珠单抗联合白蛋白紫杉醇作为PD-L1 IC+的转移性TNBC患者一线治疗具有积极的获益-风险效应。
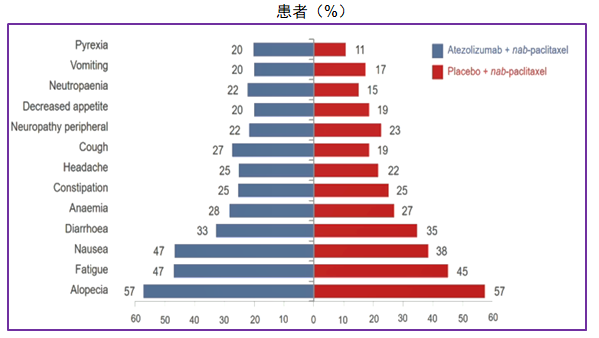
图15. 发生率≥20%的AEs
IMpassion130研究带给我们非常有临床价值的启发。既往研究显示激素会影响免疫治疗的反应[18],IMpassion130研究选择联合白蛋白紫杉醇,是因为白蛋白紫杉醇的使用无需激素的预处理,不会干扰阿替利珠单抗治疗的活性。既往在TNBC患者的Ib期研究中,均提示阿替利珠单抗联合白蛋白紫杉醇具有良好的疗效和安全性,阿替利珠单抗介导的免疫治疗效应不会被同时使用的白蛋白紫杉醇抵消[19]。白蛋白紫杉醇可增加肿瘤细胞的抗原释放,增强免疫治疗效果,且不影响免疫治疗的活性。
基于IMpassion130研究数据,2019年FDA已优先评审批准阿替利珠单抗联合白蛋白紫杉醇用于治疗PD-L1阳性的mTNBC患者,同时该治疗方案也写进了NCCN和AGO指南。该研究提示我们PD-L1阳性人群获益不仅在PFS上,OS数据也提示PD-L1+的患者人群获益更大,在未来的临床研究中,可以考虑用PD-L1+作为主要研究终点的优势亚型。
3、IMpassion131研究[20]:阿替利珠单抗联合溶剂型紫杉醇的全球多中心III期临床研究
目前正在开展国际多中心IMpassion131研究,国内17家分中心共同参与。IMpassion130的研究结果公布之后,IMpassion131很快就进行了方案修订,主要研究终点由原来的只看ITT人群的PFS改为先看PD-L1+人群的PFS,样本量也相应的从495例增加到了651例。不同于IMpassion130研究,IMpassion131选用溶剂型紫杉醇联合阿替利珠单抗,是否溶剂型紫杉醇联合阿替利珠单抗,能够获得和IMpassion130一样的结果?
2020年8月6日,罗氏公司宣布:IMpassion131研究未能显著改善晚期TNBC患者PFS,这些患者均为PD-L1阳性人群,次要终点OS也呈现负面趋势。在分析时数据还不成熟,潜在原因需要进一步探索。研究者计划继续对OS进行追踪,直至最终分析。目前,FDA未批准阿替利珠单抗联合溶剂型紫杉醇一线治疗晚期TNBC,并于2020年9月8日发表声明,建议该方案不适用于治疗TNBC患者,临床实践中不应用溶剂型紫杉醇代替白蛋白结合型紫杉醇。
三、TNBC免疫联合化疗——机遇与挑战并存
免疫联合化疗越来越多地应用于晚期和早期TNBC患者,带给临床更多的治疗机会。在晚期TNBC一线治疗中,IMpassion 130研究首次证实了PD-L1阳性的mTNBC能够从免疫联合化疗中生存获益,在早期TNBC新辅助治疗中,IMpassion 031研究的pCR率显著提升,虽然远期生存的数据尚不成熟,但是就目前的趋势来看很有可能会得到阳性的结果。临床研究结果值得我们对TNBC的免疫治疗从晚期前移到早期治疗持乐观态度。
TNBC对免疫治疗存在较大的异质性,免疫联合化疗仍然面临着诸多挑战。不同药物配伍,可能导致疗效的不确定性;如何确定合理的治疗终点也是目前值得关注的问题;如何通过检测手段预测疗效、判断预后指标,以进一步提高免疫治疗的疗效,尚需更多的数据确认。
未来发展趋势应进一步寻找与其他药物的最佳联合方案及适用人群,化疗、靶向治疗、免疫联合治疗、化靶联合、化免联合,新药物、新技术、新靶点、新方案有效组合,都是未来可以进一步探索的方向。
参考文献
1. Gonzalez H, et al. Genes & Development 2018;32:1267.
2. Chen DS, Mellman I. Immunity. 2013 Jul 25;39(1):1-10.
3. Pardoll DM. Nature Rev Cancer 2012; 12(4):252-264.
4. Emens LA, et al. Cancer Immunol Res 2015;3:436.
5. Nature Reviews Drug Discovery volume 18, pages197–218(2019).
6. Den Brok BCRT 2017.
7. NCCN 2020 V6.
8. Cardoso Ann Oncol 2018.
9. Gobbini EJC 2018.
10. Yardley Ann Oncol 2018.
11. Miles Anno Oncol 2013.
12. AVASTIN Smpc 2017.
13. Lynparza Uspi 2018.
14. JAMA Oncol . 2019 Mar 1;5(3):334-342.
15. Nadia Harbeck, et al. 2020 ESMO Abstract LBA 11.
16. Schimd P, et al. [J]. NEJM, 2018, 379(22): 2108-21.
17. L. A. Emens , et al. 2020 ESMO Abstract LBA 16.
18. Soliman HH. nab-Paclitaxel as a potential partner with checkpoint inhibitors in solid tumors. Onco Targets Ther 2016;10: 101-12.
19. Adams S, Diamond JR, Hamilton E, et al. Atezolizumab plus nab-paclitaxel in the treatment of metastatic triple-negative breast cancer with 2-year survival follow-up: a phase 1b clinical trial. JAMA Oncol (in press).
20. D. W. Miles , et al. 2020 ESMO Abstract LBA 15.
本文来源均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。


